© Ляшко Андрей Константинович, 2006-2016
ЛЯШКО А.К., к.м.н.
ЭНЗИМАТИЧЕСКАЯ АКТИВНОСТЬ
ПАТОГЕННЫХ ГРИБОВ ПРИ ОНИХОМИКОЗЕ
Основным фактором вирулентности патогенных дерматомицетов, плесеней и дрожжеподобных грибов при онихомикозе большинство исследователей считает их выраженную энзиматическую активность, и преимущественно – кератинолитическую. Последнее не вполне верно, что мы и покажем настоящим исследованием.
Говоря об энзимах, целесообразно обратиться к их классификации, чтобы составить ясное суждение о предмете. В настоящее время известно уже около 24 тыс. различных энзимов, и лишь 567 из них – гидролазы (класс КФ 3, в соответствие международной классификации ферментов – КФ). Именно последние и являются основными экзоферментами микромицетов, обнаруживая очевидное патогенетическое значение при онихомикозах/дерматомикозах. Гидролазы катализируют гидролиз (разрыв) химических связей:
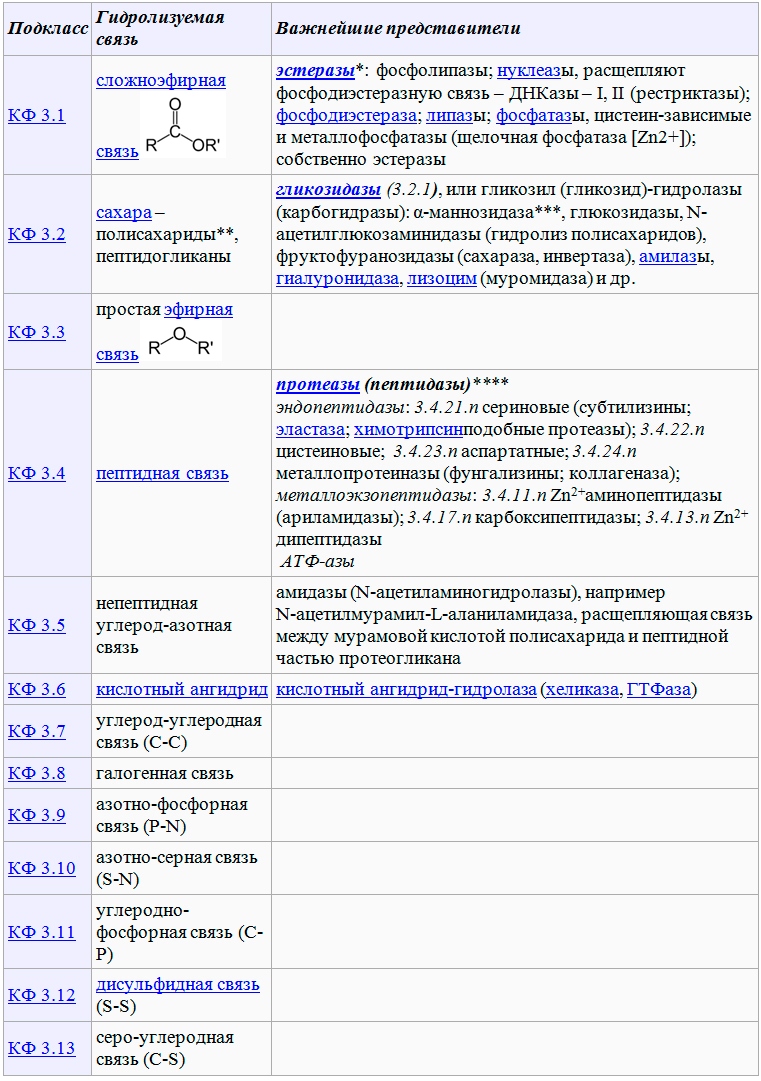
*К эстеразам в широком смысле слова относят: собственно эстеразы, липазы, фосфатазы, сульфатазы, а также нуклеазы
Нуклеазы – большая группа ферментов, гидролизующих фосфодиэфирную связь между субъединицами нуклеиновых кислот. Различают несколько типов нуклеаз в зависимости от их специфичности: экзонуклеазы и эндонуклеазы, рибонуклеазы и дезоксирибонуклеазы, рестриктазы и некоторые другие.
**Полисахаридные (гликановые) цепи образованы чередованием двух модульных структур – азотсодержащих производных глюкозы: N-ацетилглюкозамина и N-ацетилмурамовой кислоты.
***Манноза – изомер глюкозы.
****Различают эндопептидазы и экзопептидазы. Эндопептидазы, или протеиназы, расщепляют пептидную связь внутри пептидной цепи. Относительно специфично гидролизуют связи между определенными аминокислотными остатками. Протеиназы классифицируются по механизму реакции. Сериновые протеиназы содержат в активном центре важный для каталитического действия этих ферментов остаток серина, в цистеиновых протеиназах таким является остаток цистеина. Экзопептидазы гидролизуют пептиды с конца цепи: аминопептидазы – с N-конца, карбоксипептидазы – с С-конца. Дипептидазы расщепляют только дипептиды.

Активность кератиназ среди прочих протеолитических ферментов традиционно рассматривают в качестве основополагающей для вирулентности патогенных грибов.
Кератиназы – группа протеолитических ферментов, способных к гораздо более эффективному гидролизу кератинов по сравнению с другими протеазами. Продуцируются, помимо микроорганизмов, некоторыми насекомыми. Наиболее подробно исследованы кератиназы дерматомицетов Microsporum и Trichophyton, бактерий родов Bacillus и Streptomyces. Большинство кератиназ имеет сходные характеристики. Это преимущественно экзоферменты, сериновые протеиназы, за исключением кератиназ дрожжеподобных грибов – аспартатных протеиназ (а также карбоксилпептидазы Candida albicans. Кератиназы патогенных плесневых грибов изучены сравнительно мало. Молекулярная масса кератиназ варьирует от 20 до 90 килодальтон, большинство наиболее активно при щелочном рН и высокой температуре – при оптимуме вплоть до 50°C и более. По мнению Kunert J (2000), термин кератинофильные грибы следует использовать в отношении всех грибов, для которых кератиновые структуры являются естественными субстратами, а кератинолитическими являются грибы, активно деградирующие природные “твердые” кератины в эксперименте36.
Дерматомицеты характерно метаболизируют кератин. Тем не менее, кератинолитическая активность per se не может служить универсальным признаком патогенности при онихомикозах. Известно, что среди дерматомицетов она наиболее высока у Microsporum canis и M. gypseum, поражающих ногти чрезвычайно редко. По данным Okafor J (2000) кератинолитическая активность M. gypseum составила 78,8 мкг/мл против 52,5 и 43,8 у T. rubrum и T. mentagrophytes, соответственно42. T. mentagrophytes и M. gypseum в эксперименте перфорировали стержень волоса, а T. rubrum – нет. Еще ниже кератинофильность Epidermophyton floccosum, никогда не поражающего волосы51. Очевидно, что структура ногтя и местные физиологические условия много отличны от таковых волоса, и вот – уступающий микроспорумам в абсолютных показателях кератинофильности T. rubrum вызывает в условиях умеренного климата 70-90% случаев онихомикоза, активно перфорирущий волос T. mentagrophytes – только 5-20%, “аутсайдер” кератинолизиса E. floccosum – не более 1%, а блестящие (по данным стандартных тестов) кератинолитики Microsporum spp. практически вовсе не патогенны для ногтя.
Первоначальная инвазия при онихомикозе в большинстве случаев (и практически во всех случаях инфицирования T. rubrum) происходит в области гипонихия или перионихия – дериватов эпидермиса – при успешной первичной адгезии артроконидий. Однако, роговой слой эпидермиса и ногтевая пластинка – это не только кератин.
Эпидермальные протеины
1) продукты дифференцировки
- клеточные кератины (α-кератин) – не менее 25 вариантов
- различные кератин-ассоциированные протеины, формирующие матрикс для кератиновых филаментов: филаггрин (образуется из профилаггрина – основно́го компонента кератогиалиновых гранул кератиноцитов), т.н. протеины с высоким содержанием серы или глицина/тирозина и др.
- наружная (конечная) клеточная оболочка (terminal cell envelope) – заключает в себе всю массу кератиновых волокон, образована сетью перекрестно связанных между собой белков: периплакина, связанных трансглютаминазой инволукрина и энвоплакина, гидроксикерамидов (липидов), связанных с протеинами сложноэфирными связями, лорикрина, ряда малых протеинов, богатых пролином
2) протеины адгезии
- мультипротеиновые кадхериновые комплексы десмосом: трансмембранные десмоглеины и десмоколлины, внутриклеточные десмоплакины
- мультипротеиновые, преимущественно интегриновые комплексы полудесмосом базальных кератиноцитов: внутри- и межклеточные десмоплакин, коллагены ХVII (трансмембранный) и VII (якорный), плектин, ламинин, фибронектин
Итак, помимо безусловно превалирующего α-кератина, 10% липидов в stratum corneum и около 1% – в ногтевой пластине в эпидермисе и ногте содержится достаточно некератиновых протеинов и ферментов. Очевидно, что для успешного внедрения в ткани организма-хозяина грибу необходимо вначале разрушить достаточно прочный “кокон” некератиновой наружной оболочки эпидермоцитов. Естественно предположить, что более эффективный лизис некератиновой оболочки может осуществляться при помощи некератиновых, или общих, протеаз грибов. Липопротеиновый гидроксикерамидный комплекс может быть эффективно разрушен эстеразами грибов, например, щелочной фосфатазой, фосфолипазой или липазой. Установлено, что при росте на обедненных средах (minimal media), каковому может быть уподоблена начальная фаза грибковой инфекции, ведущую роль играет т.н. общая (general) протеолитическая активность дерматомицетов, связанная с активацией других ферментов, не имеющих сколько-нибудь значительной тропности к кератину, например, общих химотрипсинподобных протеиназ, кислых протеиназ, полисубстратных металлопротеиназApodaca,Lambkin, высокоактивных в отношении в том числе ламинина и фибронектина (одни из основных факторов клеточной адгезии базальных кератиноцитов к веществу базальной мембраны), гораздо менее – кератина и эластина. Очевидна важная роль металлопротеиназ. Лишение кератиноцитов адгезивных свойств вследствие энзиматической активности патогенных грибов может являться одним из ключевых моментов развития инфекции. Так, по данным исследований in vitro (сканирующая электронная микроскопия, количественное определение цитозолевой ЛДГ в супернатанте культур), помимо явлений цитотоксикоза и апоптоза главные эффекты действия дерматомицетов на культуры живых человеческих кератиноцитов включают редуцирование сети клеточных выростов кератиноцитов и выраженное снижение их пластичностиApprichV.Следовательно, кератинофильность гриба сама по себе не определяет однозначно степень вирулентности дерматомицетов. Между тем, в недавней израильской работе показано (Kaufman G et al., 2007), что специфическая эластолитическая, кератинолитическая и азоколлолитическая, или общая протеолитическая, активность T. mentagrophytes не зависят от характера субстрата (только кератина или только эластина). Кератин и эластин в данном исследовании индуцировали ферментную активность дерматомицета, не имеющую значимых различий, однако при электрофорезе в геле одна из трех полос (band 2) индуцировалась только ростом на кератине. Полосы 1и 2 идентифицированы в качестве сериновых протеиназ 20 и 80 кДаKaufmanG. Kaufman G также полагает, что главная роль некоторых ферментов, объем секреции которых незначителен, заключается в детекции, а не в деградации определенных протеиновых субстратов. Такова, по мнению автора, дипептидилпептидаза Tri m 4 T. mentagrophytes, играющая определенную роль в регулировании секреции других протеаз, метаболически активируя гены их синтеза34. Протеинами, также регулирующими, как полагают, активацию протеиназ, являются тиоредоксин и целлобиогидролаза (экзо-целлюлаза). Кроме того, известно, что тиоредоксин является фактором вирулентности гриба Pneumocystic carinii и микроаэрофильной бактерии Helicobacter pylory34.
Дискуссия о роли кератинолизиса при дерматомикозах/онихомикозах начата давно: O’Sullivan J еще в 1971 году поделился сомнениями по поводу решающей патогенетической роли кератинолизиса47. Подобное мнение высказано и рядом других исследователей. Например, сообщают об ограниченной субстратной специфичности протеиназ66,34,36, определяющей роли сульфитолизиса, разрывающего дисульфидные связи кератинов66,42,46,34,36. Kunert J (2000) полагает ошибочным использование самого термина “кератиназа”, поскольку считает кератинолитические потенции этих ферментов весьма ограниченными. Автор сообщает, что кератиназы сами по себе неспособны эффективно деградировать “твердый” кератин волосяного типа36 (из которого, как известно, на 80-90% состоит ногтевая пластина). По данным Kunert J, при деградации кератиназами структур, образованных твердыми кератинами, потеря веса образцов составляет только 5-10%, что соответствует содержанию некератинов; наиболее же легко лизируется “мягкий” эпителиальный кератин (кератины рогового слоя эпидермиса, гипонихия и ногтевого ложа), который деградируют не только кератиназы, но и активно ферментируют неспецифичные, общие протеазы36. Kunert J считает, что эффективная деградация кератина, как фактор вирулентности дерматомицетов, имеет три слагаемых: экстрацеллюлярное дезаминирование, ведущее к выделению ионов аммония и защелачиванию среды, набуханию, частичной денатурации протеинов, что облегчает сульфитолизис и протеолиз; сульфитолизис (секреция грибами сульфита); протеолиз. Очевидно, что необходимое потребление кислорода при дезаминированиии делает деградацию кератина грибами в значительной степени зависимой еще и от достаточной аэрации. Исследователи феномена сульфитолизиса полагают, что эффективный лизис твердых кератинов практически невозможен без предварительной денатурации плотной третичной структуры, протеазорезистентность которой обусловлена высоким содержанием дисульфидных связей34,35,44. Дерматомицеты характерно секретируют сульфит – в качестве редуцирующего агента, разрывающего дисульфидные связи кератина (цистина) с образованием цистеина и S-сульфоцистеина36. В результате, α-спирали кератинов становятся доступными действию различных эндо- и экзопротеаз, секретируемых грибами. Monod М (2008) полагает, что сульфитолизис является ключевым моментом, предшествующим массированной энзиматической атаке44. Ген, кодирующий транспорт сульфита, типирован у T. rubrum и Arthroderma benhamiae (зоофильный дерматомицет), а также у плесневого Aspergillus fumigatus36. Автор считает, что механизм секреции сульфита может стать мишенью для антимикотиков следующего поколения, поскольку полагает активную экзоферментную деградацию “плотно упакованного” кератина без предварительного разрушения его третичной структуры невозможной.
С другой стороны, собственно кератиназы способны разлагать не только кератин, но и другие белки, в том числе эластин и коллаген7. В самом деле, любая протеиназа способна гидролизовать пептидную связь. Возможно, следует говорить не об абстрактных границах субстратной специфичности протеиназ, а о степени сродства фермента конкретному лизируемому протеину, определяемой уникальными особенностями вторичной и третичной структур данного белка. Таким образом, эффективность протеолиза заданного субстрата разными пептидазами широко варьирует. Monod M (2002) справедливо отметил, что наши знания о субстратной специфичности грибковых протеаз, так же как и о механизмах их ингибиции, все еще весьма ограничены43. Известен ряд природных ингибиторов протеолитических экзоферментов грибов, например, фунгальный ингибитор сериновых протеаз F (FPI-F), обнаруженный в гемолимфе шелкопряда69.
Полагаем, что вирулентность гриба в значительной степени определяется разнообразием экзоферментов. Помимо активности протеаз, существенное значение может иметь секреция ряда эстераз (в том числе щелочной фосфатазы, фосфолипазы, липазы, нуклеаз), гликозидаз (например, β-глюкозидазы, α—маннозидазы), амидаз и других ферментов, в комплексе обусловливающих конечную высокую вирулентность гриба, хотя эти ферменты имеют, как правило, высокую специфичность, т.е. вполне определенную субстратную мишень. Примечательно, что липазы и фосфолипазы секретируются дерматомицетами не только на средах, содержащих липиды, но и на кератиновых и даже на глюкозо-пептонном бульоне Сабуро12,37.
По мнению Brasch J,1994, cущественное значение в патогенезе онихомикозов (дерматомицеты, Scopulariopsis brevicaulis) имеют активность щелочной фосфатазы, эстераз и лейциновой ариламидазы. Дерматомицеты активно секретировали их на волосе, stratum corneum и жидких протеиновых средах (неопептон, RPMI). Scopulariopsis spp., по сравнению с дерматомицетами, продуцирует меньше разновидностей ферментов, лишь небольшое количество щелочной фосфатазы. Наивысшей энзиматической активностью среди дерматомицетов отличался M. canis, самой низкой – E. floccosum, и оба не росли на липидных средахBrasch. Отметим, что наибольшее количество липидов в ногтевой пластинке содержится в дорзальном и вентральном ее слоях. M. canis ногти поражает исключительно редко, E. floccosum – менее чем в 1% случаев.
Возможно, протеиназы (пептидазы), активные на первой стадии инвазии, лизируют преимущественно некератиновые протеины, полипептиды и иные доступные субстраты (общая протеолитическая, или азоколлитическая, активность), обеспечивая грибковую клетку избытком аминокислот, источником жизненно необходимых элементов – С, N, S. С энзиматической точки зрения грибковая инвазия представляет собой баланс активности общепротеолитических ферментов и специализированных кератиназ, определяемый и регулируемый особенностями субстрата. Так, на бедных серой средах выявлена активность энзима Mr 27 кДа. Обогащение среды серой (органической – метионин/цистеин – или неорганической) вновь снижало экспрессию азоколлитической активности Brasch. По совпадению молекулярной массы (см. таблицу) логично предположить, что это металлопротеиназа LambkinIetal. (1994).
Предполагается, что активность мультисубстратных и специализированных некератинолитических энзимов является нутритивным источником высокой синтетической активности патогенов в первоначальной адаптивной стадии инфекции. С другой стороны, некоторое количество кератина вполне может быть утилизировано и мультисубстратными энзимами, а собственно кератиназы способны разлагать не только кератин, но и другие белки, в том числе эластин и коллагенAsahiM. Кроме того, stratum corneum содержит много липидных гранулЦераидис, что может быть чрезвычайно важно для выживания гриба в отсутствие активности кератиназ. Жирные кислоты, входящие в состав липидов, подвергаются окислению с образованием ацетил-СоА и АТФ, возможно, играя важную роль в энергетическом обмене грибковой клетки на определенной стадии инфекции.
В исследовании Muhsin на плотной среде протеаза (желатиназа) продуцировалась только дерматомицетами; высокую кератиназную активность обнаружили все 123 изолята 14 видов дерматофитов и дрожжеподобных грибов, за исключением Malassezia furfur. Активность липазы и фосфолипазы определена во всех случаях, за исключением T. violaceum. Тем не менее, остается неясным, действительно ли является некератинолитическая протеолитическая активность фунгальных патогенов при онихомикозе одним из главнейших факторов их вирулентности, поскольку активная инвазия с разрушением кератиноцитов, в отсутствие которой отвлеченные рассуждения о патогенности полубессмысленны, происходит на последующих стадиях развития инфекции при однозначном участии специализированных кератиназMuhsin.
Функции и значение секретируемых фунгальных протеаз варьируют. Очевидно, что они определяют вирулентность дерматомицетов, растущих исключительно в stratum corneum, ногтях и волосах, белки которых составляют для них единственный источник азота и углерода. Эластинотропную активность – кератиназ или специализированных эластаз – исследователи нередко ассоциируют с вирулентностью дерматомицетов и интенсивностью воспалительной реакции. Аномально высокая продукция эластаз, приводящая к образованию островоспалительных пузырей, в ряде случаев наблюдалась при микозе стоп, вызванном T. mentagrophytes, у солдат армии США во ВьетнамеBlank, H., Taplin, D. and Zaías, N.: Cutaneous Trycophyton Mentagrophytes Infections in Vietnam. Arch. Derm., 99:135-144, 1969.. Анализ ферментной активности дерматомицетов при микозах кожи показал, что энзиматическая активность ДНКазы и эластазы при острой инфекции существенно выше, чем при хронической – 93,3/78,2% и 96,6/74,0%, соответственно López—Martínez. С другой стороны, активность щелочной фосфатазы, лейциновой ариламидазы и β-глюкозидазы в случаях острого и хронического (больше 6 недель) дерматомикозов (96% последнего были вызваны T. rubrum и 4% – T. mentagrophytes) в исследовании с использованием тестовой системы ApiZYM (API Laboratoire, de Recherche) не обнаружила значимых различий. Таковые были определены в отношении α-маннозидазы, активность которой была детектирована во всех случаях острой инфекции и ни в одном – хронической (p < 0,001)Toprak. Между тем, в исследовании Scher R энзиматическая активность культур, полученных от больных с рецидивом онихомикоза, значительно превосходила таковую у прежде не леченных больных. Статистически достоверные различия между этими группами получены при сравнении активности β-глюкозидазы, липазы, ариламидазы, N-ацетил-β-глюкозаминидазы. Анализ ряда факторов, определяющих эффективность безрецедивного лечения онихомикозов, выявил гораздо более существенное значение, среди других, энзиматической активности дерматофитовScherRK. Без сомнения, высокая энзиматическая активность может быть важным фактором выживания дерматомицетов в условиях лечения онихомикозов. Определение уровня энзиматической активности дерматофитов могло бы, возможно, иметь важное клиническое значение при выборе тактики лечения рецидивов онихомикозов.
По мнению Zaugg C et al.,2008, в инфекции T. rubrum важную роль может играть секреция металлокарбоксипептидазы (TruMcpA, по классификации MEROPS, гомологична человеческой панкреатической карбоксипептидазе А), продуцируемой в виде профермента и активируемой одновременно секретируемыми субтилизинами (сериновые эндопептидазы). Определена также мембранная экспрессия якорных сериновых карбоксипептидаз семейства S10, гомологичных карбоксипептидазам, секретируемым Aspergillus и Penicillium. Полагают, что эти энзимы могут иметь существенное значение – в кооперации с эндопротеазами и аминопептидазами – при деградации плотных кератиновых тканей в ассимилируемые аминокислоты и короткие пептидыZaugg.
Многие виды патогенных для человека грибов секретируют протеазы in vitro и in vivo. Детекция патогенетически значимой активности литических ферментов у дрожжеподобных и плесневых грибов, при онихомикозах ранее считавшихся просто контаминантами или же возбудителями с недоказанной патогенностью, может рассматриваться в качестве доказательной базы самостоятельной вирулентности последних, нередко единственно изолируемых при онихомикозе инфекционных агентов.
По данным Monod M et al.,2002, секретируемые эндопротеазы патогенных грибов относятся к аспартатным протеазам семейства пепсина, сериновым протеазам семейства субтилизинов и металлопротеиназам двух разных семейств. К этим протеазам следует добавить непепсинового типа аспартатную протеазу Aspergillus niger и уникальную химотрипсинподобную протеазу Coccidioides immitis. Патогенные грибы секретируют также аминопептидазы, карбоксипептидазы и дипептидилпептидазыMonodMetal.
Секреция аспартатных протеаз (не менее 10 членов семейства), секретируемых Candida albicans и другими представителями рода Candida LianCH, LiuWD является важнейшим моментом непосредственной пенетрации гриба в ткани после первоначальной адгезии, а также и взаимодействия с иммунной системой макроорганизма. Впрочем, знания о субстратной специфичности грибковых протеаз, так же как и о механизмах их ингибиции, все еще весьма ограниченыMonodMetal. Говоря о субстратной специфичности, следует подчеркнуть определенные биохимические различия в содержании ряда компонентов между ногтевой пластиной, stratum corneum и волосом, в % (Табл. 1).
Таблица 1. Сравнительный химический состав кератиновых структур кожи
| Сера | Цистин | Глицин | Липиды | |
| Ногтеваяпластина | 3,2 | 10,6 | 7,9 | 0,1-1 |
| Stratum corneum | 1,4 | 1,2 | 24,5 | 10-20 |
| Волос | 4,5 | 15,9 | 5,8 |
0,7-1,3 |
Биохимические отличия наиболее выражены в отношении содержания цистина и серы. Аминокислотный состав ногтевой пластины, рогового слоя эпидермиса и волоса существенно различен, особенно в отношении цистина и глицина. В целом, по составу аминокислот ногтевая пластина биохимически гораздо ближе к волосу, чем роговому слою эпидермиса из-за превалирования “твердых” волосяных кератинов (80-90%). Для избирательной аффинности грибковых патогенов, возможно, имеет значение также и различие в содержании микроэлементов в эпидермисе, волосах и ногтях – кальция, железа, магния, хрома, фосфора, селена, цинка, кадмия, меди, свинца и висмута. По результатам исследования атомной абсорбционной спектрометрией цинка и меди в волосах больше, чем в ногтях, а уровень висмута, кадмия и железа – ниже31. Известно, что липидов в ногтевой пластине мало, наибольшее их количество содержится в вентральном и дорзальном слоях35. Поскольку ногтевое ложе содержит исключительно “мягкие” эпителиальные кератины, можно предположить, что и по содержанию липидов оно ближе к эпидермису, чем к ногтевой пластине. Таким образом, роль липаз может приобретать важное патогенетическое значение.
Примечательно, что способность микроорганизмов к продукции экзоферментов обычно оценивается при исследовании лабораторных штаммов/изолятов в стандартных условиях in vitro. Забавно, что часто используемый казалось бы серьезными исследователями кератин-азур (keratin azure), является импрегнированным азуром кератином шерсти овец. Какое отношение он может иметь к онихомикозу человека? Очевидно, что более чем маргинальное. Тем более, что этот стандартный голубой лабораторный кератин, например Sigma-Aldrich Keratin azure, Product Number K8500 является еще и отчасти денатурированным (partially denatured). По данным Simpanya M, активность протеиназ (в том числе лейцил-аминопептидазы) и кератиназ ряда дерматомицетов значительно возрастает при росте на чистом кератине по сравнению с обычными средами, что, тем не менее, по мнению автора не может быть прямо ассоциировано с патогенностью в отношении реальных кератинсодержащих структур in vivo68. С другой стороны, в исследовании Oycka C и Gugnani H отмечена более высокая активность патогенных грибов в отношении фрагмента ногтя (in vitro), чем кератиновой пудры51: тестировались репрезентативные изоляты мицелиальных недерматомицетов Scytalidium dimidiatum, S. hyalinum, Scytalidium japonicum, Fusarium solani и дерматомицетов T. rubrum и T. mentagrophytes. S. dimidiatum деградировали 42-43% образцов ногтя и 24-26% – чистого кератина; S. hyalinum и S. japonicum деградировали 40% и 38% образцов ногтя, соответственно, деградация кератина была незначительной; F. solani деградировал 43% образцов ногтя и 20% – кератина. Дерматомицеты были наиболее активны – 70-73% образцов ногтя и 42-52% – кератина51. Необходимо отметить, что принципиальное значение имеет то, какой именно кератин использовался исследователем, поскольку содержание серы и цистина в волосяном и эпидермальном кератинах кардинально различно.
Внедрение и укоренение патогенных грибов при онихомикозе в громадном большинстве случаев происходят в гипонихии и ногтевом ложе. Гипонихий и ногтевое ложе – структуры, содержащие исключительно эпидермальные кератины. Гипонихий, морфофункционально, является эпидермисом кончика пальца54. Значит, аминокислотный профиль и химический состав гипонихия и ногтевого ложа совершенно отличны от таковых ногтевой пластины. Эти факты упущены исследователями, делающими акцент на изучении кератинолитических свойств патогенных грибов как фактора вирулентности с использованием образцов ногтевых пластинок (преимущественно состоящих из волосяных кератинов) и, тем более – использующих для этих целей тест перфорации волоса. Сложность корреляции данных лабораторных биохимических исследований с действительной патогенностью – камень преткновения при определении вирулентных свойств грибов. Патогенные грибы могут не экспрессировать (активизировать) ряд вирулентных генов in vitro, а только in vivo. Возможно и обратное. Поэтому, результаты исследований экзоферментов in vitro не всегда могут быть соотнесены с действительными факторами вирулентности в условиях реальной инфекции, способностью вызвать онихомикоз. Очевидно, что истинные патогенные свойства грибов не могут быть определены деградацией кератин-азура. Предпочтение должно быть отдано если не исследованиям in vivo ввиду их дороговизны и технической сложности, то, по крайней мере ex vivo образцам ногтей волонтеров. Известно, что многие виды патогенных для человека нитчатых и дрожжеподобных грибов секретируют протеазы in vitro и in vivo, что, однако, не может рассматриваться в качестве однозначного доказательства их вирулентности для человека без однозначного клинического и микологического подтверждения (четкие симптомы онихомикоза, моноинфекция, повторное микологическое подтверждение, излечение по применении антимикотика, к которому данный гриб чувствителен). Для безусловного подтверждения вирулентности требуется гистологическое свидетельство инвазивности поражения. Гифы и споры в глубине тканей ногтевой пластины/ногтевого ложа определяются окраской ШИК/PAS, по Гроко (Grocott – метенамином серебра), по Граму-Вейгерту, иммуногистохимически, а также при помощи люминесцентной конфокальной микроскопии (для последней – в том числе in vivo). Дело недалекого будущего – 3D микроскопия, каковая уже довольно широко используется в диагностике злокачественной меланомы.
Вопросы регуляции синтеза и секреции протеаз грибами пока еще далеки от ясного понимания. Известно, что ферментная активность грибов носит двоякий характер: конститутивный и адаптивный. Известно также, что характер секреции экзоферментов не всегда определяется биохимическими особенностями субстрата, как принято считать, но и фазами роста гриба (фазами инфекции), влиянием внешних условий. Ряд экзоферментов секретируется конститутивно и в отсутствие протеинового субстрата, особенно в начальной фазе роста (инфекции)16,71,4. У T. rubrum конституитивная активность экзоферментов подтверждена и в фазе стационарного роста5. Генетическая изменчивость грибов высока, экспрессия генов (в том числе определяющих уровень секреции различных экзоферментов) значительно варьирует – даже среди изолятов одного вида. Ферментная активность во многом определяется многообразными реальными условиями инфекции in vivo (характер субстрата, температура, относительная влажность, рН, оксигенация, присутствие физиологических фунгицидных веществ, бактерий, сапрофитных грибов и другое).
В настоящее время существуют базы данных экспрессии генов (в том числе – генов протеиназ) патогенных грибов, в том числе T. rubrum. При помощи такой компьютерной базы и методик генетического microarray зондирования (метод развился из Southern blotting ) легко детектировать активизацию тех или иных нуклеотидных последовательностей ДНК, дать характеристику динамической экспрессии генов на разных стадиях инфицирования, отличать реинфекцию от рецидива, давать прогноз чувствительности к антимикотикам в конкретном клиническом случае и многое другое. Полной базой экспрессии генов T. rubrum с успехом пользуются китайские исследователи (TrED: the Trichophyton rubrum Expression Database). Таким образом, функциональная генетика в исследованиях патогенных грибов выходит на ведущие позиции. Это объективная мировая тенденция и не считаться с ней нельзя.
Значительной кератинолитической активностью обладают и плесневые нитчатые грибы – Scopulariopsis, Scytalidium, Aspergillus, Fusarium, Acremonium, GeotrichumJ.Friedrich, Trichosporon. Активно лизируют кератин и образцы ногтевых пластинок представители родов Fusarium – определена секреция аспартатных протеиназ – и ScytalidiumOyckaCA, GugnaniHC. Acremonium spp. и Fusarium oxysporum, вызывающие классическую белую поверхностную форму онихомикоза в эксперименте разрушают ногтевые пластинки, как и T. mentagrophytesHayR, BaranR. В ряде тропических регионов (Латинская Америка, ряд стран Карибского бассейна, Магриба) S. dimidiatum (анаморф Nattrassia mangiferae, старое название последнего – Hendersonula
toruloidea) и в меньшей степени – S. hyalinum, являются главнейшими патогенами при онихомикозе.
По данным National Skin Centre, Singapore, в 2001 году Fusarium spp. вызвали 10,3% онихомикозов, Scytalidium spp. – 1,9%, Candida spp. – 22,4%.
Кератинолитической активностью, превосходящей литические свойства прочих плесневых грибов, сравнимой с активностью патогенных дерматомицетов, обладают аскомицеты рода ScopulariopsisFilipelloMarchisioV. Scopulariopsis brevicaulis – наиболее частый плесневый патоген в Европе (1-5% всех онихомикозов). α-кератинолитические энзимы Scopulariopsis spp. не столь активны, как ферменты дерматомицетов, но патогенетически достаточно активны для первичного поражения. В исследовании Marchisio VFilipelloMarchisioV истинные кератолитические свойства (полный лизис человеческого волоса in vitro) определены у трех изолятов S. brevicaulis из девяти). Авторы полагают, что это свидетельствует о несомненных свойствах гриба как первичного патогена. Прибавим, что с другой стороны, это указывает и на высокую степень изменчивости патогенных свойств/вирулентности среди штаммов даже одного вида у грибов. Известно не менее двух экстрацеллюлярных сериновых кератиназ S. brevicaulis. Оптимум pH для обеих – 7,8, температурный оптимум – 40 и 35оС, молекулярная масса – 40-45 и 24-29 кДa, соответственноMalviyaHK. Симптомы поражения ногтя S. brevicaulis могут быть различны, чаще наблюдается проксимальный подногтевой онихомикоз большого пальца стопы у пожилых людей. Поражение возникает самостоятельно или может быть вторичным по отношению к травме или, возможно, инфицированию дерматомицетами. В исследовании почвенных изолятов кератинофилов Anbu P (Индия, 2006) кератинолитическая активность S.brevicaulis была выше, даже чем у T. mentagrophytes)AnbuP. Родственная Scopulariopsis spp. Pseudallescheria boydii является распространенным первичным онихопатогеном у лошадей (white line disease); иногда обнаруживается и при исследовании ногтей у людей, но патогенетическое значение у человека неизвестно.
Apprich V исследовал морфологические последствия активности двух изолятов дерматомицетов и четырех – плесневых грибов (Microsporum gypseum, T. mentagrophytes, S. brevicaulis, Alternaria alternata, Geotrichum candidum, Penicillium spp.) колориметрически и электронномикроскопически в отношении культур живых человеческих кератиноцитов. Лишь дерматомицеты и S. brevicaulis обнаружили высокую цитотоксичность с утратой кератиноцитами адгезивных свойств, индукцией апоптоза, фрагментацией ДНК и цитоплазматических структурApprichV. Между тем, малая часть плесневых грибов вообще неспособна к деградации кератина.
Aspergillus spp. (А. flavus, A. fumigatus, A. terreus, A. versicolor) – вторые по значимости в Европе плесневые патогены при онихомикозахIssakainen; Torres—RodriguezJM, Lopez—Jodra. Аспергиллы вызывают дистальный подногтевой или белый поверхностный онихомикоз, ведущий к частичному или тотальному дистрофическому поражению ногтя. Второй же по значимости возбудитель оппортунистических микозов (чаще – A. flavus) после Candida spp.
Типичная клиническая картина – белый как мел утолщенный ноготь, быстрое поражение ногтевой пластинки, болезненная перионихия без гноя. A. fumigatus способен утилизировать кератин в качестве единственного источника углерода и азота. В эксперименте деградация кератин-азура (оптимум рН – 9,0) A. fumigatus блокируется привнесением низкомолекулярных источников С и NSantosR. У аспергилл подтверждена секреция металлопротеиназ, аспартатных протеиназReichardU (например, аспергиллопепсина F: катализирует гидролиз главных структурных протеинов базальной мембраны, эластина, коллагена, ламинина, pH оптимум 5,0 для эластина-Конго красного), нередко строением и свойствами весьма напоминающих аналогичные ферменты дерматомицетов.
Эндопептидазы и экзопептидазы, секретируемые дерматомицетами, подобны таковым энзимам рода AspergillusMonod. Кератинолитическая металлопротеаза клинического изолята Microsporum canis (43,5кДа), обнаружившая значительную активность в отношении кератин азура, эластин конго красного и азоколла при оптимальном рН~8,0, оказалась 60% гомологом аминокислотной последовательности N конца секретируемой Aspergillus fumigatus металлопротеазы и нейтральной протеазы A. oryzaeBroutaF. Однако, в отличие от последних, эндопротеазы дерматомицетов весьма многочисленны и являются членами двух больших семейств – субтилизинов (сериновые протеазы) и фунгализинов (металлопротеазы)Monod. К тому же, дерматомицеты секретируют сульфит – в качестве редуцирующего агента, разрывающего третичные дисульфидные связи кератина (цистина) с образованием цистеина и S-сульфоцистеинаLéchenneB. В результате α-спирали кератинов становятся доступными действию различных эндо- и экзопротеаз, секретируемых грибами. Сульфитолизис, по-видимому, является ключевым моментом, предшествующим массированной энзиматической атакеMonod. Ген, кодирующий транспорт сульфита типирован у A. fumigatus, T. rubrum и Arthroderma benhamiae (телеоморф T. mentagrophytes)LéchenneB. Автор полагает, что механизм секреции сульфита может стать мишенью для антимикотиков следующего поколения, так как считает невозможной утилизацию “плотно упакованного” кератина без предварительного разрушения его третичной структуры. Типирование генов, кодирующих синтез соответствующих ферментов и субстратов, имеющих патогенетическое значение, является быстро развивающимся направлением исследовательской микологии. Однако, следует заметить, что от экспрессии гена in vitro до существенной энзиматической активности – “дистанция огромного размера”, и просто наличие гена вовсе не свидетельство патогенетически значимой ферментной активности in vivo.
В обзоре Morschhäuser J, Köhler G, Hacker J (1996) основными факторами вирулентности Cryptococcus neoformans, Aspergillus fumigatus и Candida albicans названы продукция адгезинов, протеаз и полисахаридных капсул патогеном и состояние иммунной системы макроорганизма MorschhäuserJ, KöhlerG, HackerJ. Ghannoum M (2000) считает секрецию фосфолипаз одним из определяющих факторов вирулентности Candida spp., Cryptococcus neoformans и Aspergillus fumigatus, в особенности для CandidaGhannoum MA.
Rhodotorula spp. иногда изолируют в качестве возбудителя оппортунистической инфекции (с органным поражением, менингитом, эндофтальмитом, фунгемией, сепсисом) у больных с подавленным иммунитетом – лейкемией, СПИД и т.д.
В последнее время в Санкт-Петербурге все чаще выявляют иммунокомпетентных больных с онихомикозом, вызванным Rhodotorula, часто в ассоциации с бактериальной флорой, например, Мicrococcus. Такие случаи весьма резистентны к лечению. Rhodotorula не ферментирует углеводы, но обладает уреазой. В эпидермисе мочевина обнаруживается на поверхности кератиноцитов. Мочевина – конечный продукт деградации аминокислот, источник легкоусваиваемых углерода и азота.
Механизмы адгезии Candida albicans изучены довольно хорошо. Известно, что большинство патогенных грибов способно проникать в нормальные клетки макроорганизма, индуцируя свой собственный эндоцитоз. Однако, патогенетически центральный момент инфекции – внутриклеточная инвазия – исследован мало. Инвазия может происходить при ферментном повреждении/разрыве мембраны или по тонкому, т.н. зиппер-механизму, через взаимодействие сигнальных протеинов гриба с рецепторами клеточной мембраны и дальнейший эндоцитозный захват гриба индуцированной клеткой. Так, грибы Candida могут связываться с N-кадхерином аблюминальной поверхности эндотелиальной клетки с последующими перестройкой микротрубочек и микрофиламентов эндотелиоцита, формированием псевдоподий и эндоцитозом.
С другой стороны, ключевым фактором вирулентности C. albicans полагают способность к взаимной конвертации между овоидными бластоспорами и филаментными гифамиSavilleSP. Ультраструктурные исследования позволяют утверждать, что гифы являются инвазивной формой гриба, поскольку определяются глубоко внутри эпителиальных клеток (цитоплазменная интернализация), в то время как бластоспоры преимущественно обнаруживают либо на поверхности эпителиоцитов, либо между ними. Таким образом, образование гифов рассматривается в качестве важного самостоятельного патогенетического фактора. Сверх того, установлено, что неспособные к образованию мицелия штаммы C. albicans являются авирулентнымиLoHJ. Установлено, что конидии и гифы A. fumigatus способны индуцировать собственный эндоцитозZhangZ. Повреждение инвазированной клетки может быть совершенно минимальным. Инвазивные грибы способны по-разному воздействовать на биохимические процессы пораженных клеток: блокировать апоптоз эпителиальных клеток, поддерживая их жизнеспособность, или, напротив, индуцировать апоптоз эпителиоцитов.
Дерматомицеты – гиалиновые мицелиальные грибы, характерно метаболизирующие кератин. Однако кератинолитическая активность per se не может служить универсальным признаком патогенности гриба при онихомикозах. Хотя бы потому, что по ряду данных, среди дерматомицетов наиболее высока она у M. canis и M. gypseum и – 78.8 µg/ml (M. gypseum) против 52.5 и 43.8 у T. rubrum и T. mentagrophytes, соответственноOkaforJI. Еще ниже активность E. floccosum, никогда не поражающего волосы. Однако, T. mentagrophytes и M. gypseum в эксперименте перфорировали стержень волоса, а T. rubrum – нет. Активность лизиса кератина прямо пропорционально изменяла рН среды в сторону увеличения OkaforJI. Впрочем, последнее является характерной чертой протеолиза скорее трихофитонов, в результате которого выделяется избыток аммония, защелачивающий среду. Рост Microsporum на тех же средах не вызывает детектируемого снижения кислотности среды. И, пожалуй, некорректно судить о кератинолитических свойствах дерматофитов при онихомикозах по стандартному тесту лизиса волоса, как это делает большинство авторов. Структура ногтя и местные физиологические условия много отличны от таковых волоса, кератин ногтевого ложа – “логова” инфекции – сугубо эпидермального типа; и вот – много уступающий Microsporum spp. T. rubrum вызывает в условиях умеренного климата 70-90% случаев онихомикозов, активно перфорирущий волос T. mentagrophytes – 5-20%, аутсайдер кератинолизиса E. floccosum – в пределах 1%, а блестящие (по данным стандартных тестов) кератинолитики Microsporum spp. практически вовсе не патогенны для ногтя. Значит, дело не только в метаболизации кератина. Более того, в исследовании Oycka CA и Gugnani HC отмечена значительно отличающаяся активность патогенных грибов в отношении фрагмента ногтя и кератиновой пудры: тестировались репрезентативные изоляты мицелиальных недерматомицетов Scytalidium dimidiatum, S. hyalinum, Scytalidium japonicum, Fusarium solani и дерматомицетов T. rubrum и T. mentagrophytes. S. dimidiatum деградировали 42-43% образцов ногтя и 24-26% – чистого кератина. S. hyalinum и S. japonicum деградировали 40 и 38% образцов ногтя, соответственно; деградация кератина была незначительной. F. solani деградировал 43% образцов ногтя и 20% – кератина. Дерматомицеты были наиболее активны – 70-73% образцов ногтя и 42-52% – кератинаOycka CA. Нельзя не отметить, что патогенные грибы гораздо охотнее утилизируют ногтевую пластинку, чем просто кератин. Это еще одно свидетельство, подтверждающее скудость представления о кератинолитических потенциях гриба per se как о единственно значимом факторе его вирулентности при онихомикозах.
Итак, однобокое представление об энзиматической активности грибов – патогенов ногтя как специализированной активности сугубо кератинолитических ферментов осталось в прошлом. Только полиэнзиматический характер экзоферментной активности обеспечивает достаточную вирулентность патогенов ногтя при онихомикозе.










