© Ляшко Андрей Константинович, 2006-2016
А.К. Ляшко, К.И. Разнатовский
ОСОБЕННОСТИ ПАТОГЕНЕЗА И
СОВРЕМЕННАЯ КОМПЛЕКСНАЯ ТЕРАПИЯ ОНИХОМИКОЗА
Кафедра дерматовенерологии государственного общеобразовательного учреждения дополнительного профессионального образования Санкт-Петербургской медицинской академии последипломного образования
По данным ВОЗ, каждый пятый житель нашей планеты страдает грибковыми заболеваниями кожи и ее придатков. Наиболее распространены онихомикозы – поражение грибами ногтевых пластинок кистей и стоп. При этом число таких больных во всем мире, в том числе и в Российской Федерации, ежегодно увеличивается. По данным самого крупного европейского эпидемиологического проекта ‘Ахиллес’, заболеваемость онихомикозом в Европе достигает 26,9% Изолированный онихомикоз встречается редко, чаще на кисти. Обычно tinea unguium ассоциирована с tinea pedis или tinea manuum. Проблема безрецидивного лечения онихомикоза является настоящим вызовом современной дерматологии. Несмотря на широкий арсенал современных препаратов и обнадеживающие результаты определения минимальных ингибирующих и фунгицидных концентраций антимикотиков in vitro, их клиническая эффективность недостаточна.
Аксиоматично, что в России, западноевропейских странах и США примерно в 90% всех случаев возбудителем заболевания является антропофильный дерматомицет Trichophyton rubrum. Уникальные иммуносупрессорные свойства последнего подавляют защитные цитотоксические Т-клеточные реакции организма, что приводит к хронизации инфекции. Дрожжеподобные грибы и мицелиальные недерматомицеты (плесени) могут самостоятельно поражать ногтевые пластинки иммунокомпетентных лиц; в настоящее время многие из этих патогенов рассматриваются в качестве самостоятельных возбудителей, а не только как условно-патогенная флора. На практике, к сожалению, развернутый диагноз, основанный на обнаружении конкретного возбудителя микоза, обычно не ставится, а ограничивается только “обезглавленным” ‘онихомикоз’.
T. rubrum – самый частый возбудитель онихомикоза, микозов гладкой кожи, может поражать пушковые волосы, в которых элементы гриба располагаются как по типу эндотрикс, так и эктотрикс.
Особенностями патогенеза руброфитии, помимо кератинолитической и разнообразной полисубстратной ферментной активности, являются:
- Генетическая предрасположенность больных к заражению T. rubrum. Частота случаев заражения в семьях существенно выше среди кровных родственников.
- Кератины ногтевого ложа – ‘стримлайна’ грибковой инвазии – это кератины эпидермального типа, в отличие от преобладающих кератинов волосяного типа в собственно ногтевой пластинке.
- Частое сочетание микоза с классическим (экстринсивным) атопическим дерматитом, сухостью, ихтиозиформностью кожи, вегететивными нарушениями.
- Снижение уровня клеточного иммунитета (отрицательные реакции на внутрикожное введение антигена T. rubrum – трихофитина).
- Недостаточность системы эпидермальных дефенсинов.
- Аменсализм T. rubrum – способность к активному подавлению и вытеснению нормальной эпидермальной флоры.
- Активная пространственная ориентация зародышевых трубок и векторная инокуляция артроспор.
- Феномен сульфитолизиса.
- Способность к продукции протективных полисахаридных мембран агрегациями гифов.
В разных случаях T. rubrum вызывает поражение ногтей по нормотрофическому типу, гипертрофическому или атрофическому типам. Последние клинические формы характеризуются особым упорством течения, более частыми рецидивами, более выраженными косметическими дефектами, имеют выраженную социальную значимость для фрустрированного невозможностью или мнимой невозможностью выполнения целого ряда желаний и социальных функций больного, вызывают депрессивные состояния, иногда соматизированные.
Предположение, что особенности клинического течения онихомикоза могут в существенной мере определяться имеющимися нарушениями в системе вегетативной регуляции, представляется верным.
Неуклонный рост стрессогенности жизни и т.н. “сенсорное отравление” не проходит для человека бесследно. На первый план выходят не классические органические заболевания, а функциональные расстройства различных органов и систем, преморбидные состояния. Отрицательные психоэмоциональные импульсы через взаимные нейрональные связи лимбической системы, гипоталамуса, таламуса, ряда отделов преимущественно лобной и височной большой коры нарушают обмен многих нейрогормонов и нейротрансмиттеров, дестабилизируют функциональное состояние иерархически главенствующих центров вегетативной, гормональной (нейроэндокринной) систем, механизмы психонейроиммуномодуляции, вызывают различные психосоматические заболевания, имеющие при превалировании автономных расстройств теперь конкретное название – “вегетозы”. Через полисинаптические нейроны ретикулярной формации патологические корковые, лимбические и гипоталамические стимулы оказывают серьезное раскоординирующее влияние на безошибочное функционирование вегетативных ядер ствола мозга, вызывая разнообразные нарушения регуляторных влияний на сосудистые и трофические реакции, реологию крови и т.д. Особенно страдают акральные ткани, в том числе аппарат ногтя. Одним из непосредственных патологических механизмов разрушительного влияния хронического дистресс-синдрома (Г. Селье) является нарушение синтеза эндорфинов и энкефалинов клетками ЦНС. В частности, извращенные влияния ‘дирижера-гипоталамуса’ значительно снижают освобождение эндорфинов аденогипофизом и вентральной тегментальной областью среднего мозга (последней активно секретируются β-эндорфин и дофамин). Эндорфины – антистрессовые гормоны, физиологический противовес гормону дистресса, страха и тоски – адреналину. При хроническом стрессе происходит истощение их секреции, что приводит к эндокринным и вегетативным нарушениям, в частности, развитию стойкого спазма периферических сосудов. Также наблюдается нарушение баланса выработки адреналина и норадреналина – гормона творческого стресса, концентрации, воли и ярости (т.н. гормон “львов”), дисбаланс адренергической и холинергической активности вегетативных структур ствола головного мозга. Может существенно нарушаться нейромедиаторный обмен дофамина (substantia nigra среднего мозга), отвечающего, в том числе, за чувство удовольствия, и антидепрессивного серотонина (ядра шва ствола мозга), обеспечивающего приподнятое, рабочее настроение и достаточный синтез мелатонина, регулятора циркадных ритмов. Тоска, немотивированные страхи, депрессия и бессонница, вегетозы – вот порочный круг информационного негатива и нарушенного ритма жизни современного цивилизованного общества.
Известно, что физиологический рост ногтевой пластины составляет не более 3 мм в месяц для кисти и не более 1,5 мм – для стопы. При нарушениях кровообращения и естественном (генетически детерминированном) медленном росте ногтей скорость отрастания ногтя неудовлетворительна и требует 12-18 месяцев для полного замещения тканей ногтя – от корня до дистальной части. Особенно медленно обычно (примерно, в 9 случаях из 10) растут ногти больших пальцев стоп. Итак, очевидно, что системная терапия антимикотиками, будучи in vivo только фунгистатической, при поражении ростовой зоны ногтя (клинически – тотальная дистрофическая форма поражения – TDO) не может быть эффективной в большинстве случаев, поскольку обычно препараты не назначаются per os на срок более 3-6 месяцев. Поэтому лишь комплексная патогенетическая терапия онихомикоза способна выполнить сложную задачу гарантированной санации всего аппарата ногтя.
Целью настоящей работы явилось выяснение роли вегетативных, микроциркуляторных и гормональных нарушений в развитии онихомикоза (ОМ) и разработка патогенетически обоснованной комплексной терапии этого заболевания.
Задачей исследования явилась разработка патогенетически обоснованной комплексной терапии онихомикоза и оценка эффективности такого лечения.
Материал и методы исследования
Нами обследовано и пролечено 226 больных различными формами онихомикоза, обратившихся за медицинской помощью в дерматовенерологическое отделение клиники НИИ медицинской микологии СПБ МАПО и ряд частных клиник Санкт-Петербурга в 2007-2012 годах.
Структура заболеваемости оказалась следующей: женщины составили 58,2%, мужчины – 41,8%. Возраст больных колебался от 20 до 84 лет. Контрольную группу (n=127) составили пациенты, получавшие стандартную комбинированную терапию онихомикоза: курсовое лечение системными антимикотиками (тербинафин или итраконазол) плюс местное лечение антифунгальными растворами.
Группа больных, получавших комплексное лечение (А) и контрольная группа (Б) по параметрам возраста и пола достоверных различий не составили (p > 0,05).
При обследования пациентов использована амбулаторная карта, включающая следующие разделы: анамнестические, клинические, эпидемиологические характеристики, данные объективного, лабораторного и инструментальных обследований. Пациенты с тотально-дистрофической формой поражения больших пальцев стоп статистически были равночастны в обеих группах. Их число составило 37,2% и 35,4%. Больные нормотрофической формой онихомикоза составили (18,5% и 17,8%, соответственно; гипертрофической – 61,2% и 59,5%; атрофической (онихолитической, по Ариевичу) – 20,3% и 22,7%. Последняя форма в большинстве случаев наблюдалась у молодых женщин и женщин среднего возраста со склонностью к акроцианозу и озноблению кистей рук, гипотонией; скорость отрастания ногтей обычно была существенно снижена.
Характеристика центральных представительств вегетативной нервной системы (ВНС) оценивалась по уровню опиоидных нейропептидов и их корреляции с психоэмоциональными нарушениями.
Содержание нейропептидов, в частности, бета-эндорфина в плазме крови определялось радиоиммунологическим методом с помощью набора стандартных сывороток фирмы «IMMUNO-CORPORATION»(США).
Для оценки нейро-трофических расстройств в пораженных конечностях проводилось определение нарушений оксигенации тканей и периферической микроциркуляции пальцев кистей и стоп. Транскутанное определение напряжения кислорода проводили при помощи прибора ТСМ-2 фирмы «Radiometer» (Дания).
Количественный показатель оксигенации тканей, парциальное напряжение кислорода в тканях (рО2), определяли в наших полярографическим методом с помощью полярографа LP7 E (Чехия).
О функциональном состоянии системы гипоталамус-гипофиз-гонады (ГГН) судили по содержанию в сыворотке крови: 1) гонадотропинов – фолликулостимулирующего (ФСГ) и лютеинизирующего (ЛГ) гормонов; 2) половых гормонов – тестостерона, прогестерона, эстрадиола; 3) кортизола. Для количественного определения гормонов в сыворотке крови использовали радиоиммунологический метод. В ходе исследования использовали наборы фирмы «Sea-Ire-Sorin»(Франция-Бельгия-Италия).
Контрольную группу в инструментальных исследованиях составили 50 здоровых лиц. Значимых гендерных и возрастных различий по сравнению с группами пациентов А и Б не было.
Результаты исследований
Результаты исследования активности центральных представительств вегетативной нервной системы, экстраполированной к уровню опиоидных нейропептидов в крови, свидетельствуют о различии содержания бета-эндорфина в зависимости от формы поражения ногтевой пластиники.
Концентрация бета-эндорфина в крови больных гипертрофической и атрофической формой ОМ значительно снижена и составляет 3,86+0,68 и 4,62+0,72 пмоль/л соответственно (р<0,01), а у больных нормотрофической формой ОМ она несколько снижена – до 6,53+0,71 пмоль/л, но недостоверно (р >0,05) – таблица 1.
Таблица 1. Уровень β-эндорфина в плазме крови больных
разными формами онихомикоза и у здоровых лиц
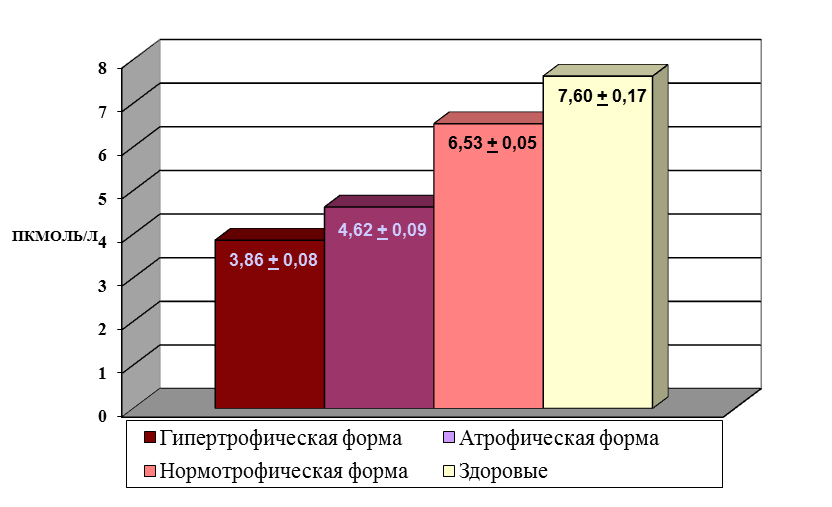

Таким образом, у больных ОМ предполагается недостаточная приспособленность к воздействия психоэмоциональных стрессоров и слабость (неадекватность) адаптивных реакций, что ведет к росту истощающего психоэмоционального напряжения, дестабилизации регуляторных влияний центральных и сегментарных представительств вегетативной нервной системы на функции органов и систем всего организма.
Исследованием оксигенации тканей ногтевых валиков пальцев кистей и стоп у больных ОМ методом чрескожной полярографии было определено характерное снижение в них напряжения кислорода, рО2 – таблица 2.
Таблица 2. Показатели оксигенация кожи ногтевых валиков у больных различными формами онихомикоза и у здоровых лиц
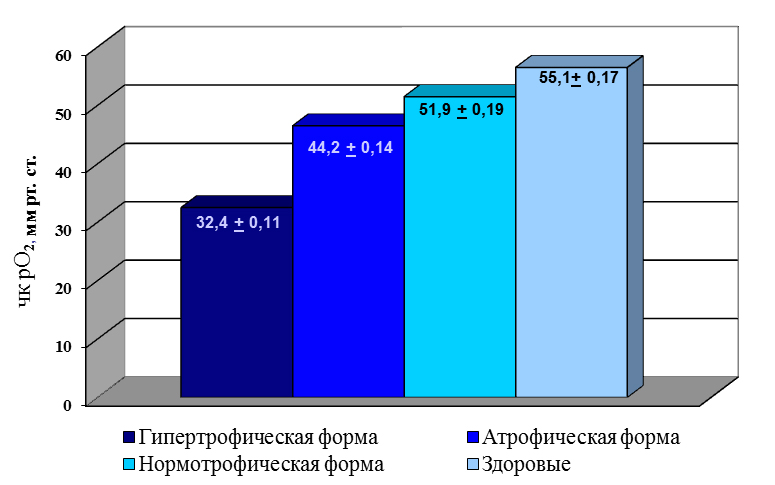

При нормотрофическом ОМ наблюдалось незначительное снижение рО2. Атрофический тип ОМ характеризовался более значительным снижением, в среднем на 20+5% ниже нормы. При гипертрофическом ОМ исследования выявили глубокие изменения в кислородном режиме тканей (до 50+4 % ниже, нормы).
Уровень оксигенации тканей ногтевых валиков пальцев кистей и стоп соответствует особенностям их кровоснабжения. На уровне микроциркуляторного русла типы оксигенации тканей зависят от количества функционирующих капилляров, сосудистого тонуса, внутритканевого давления, проницаемости капилляров и в значительной мере определяются степенью метаболических нарушений. Установлено, что оксигенация ногтевых валиков коррелирует с уровнем бета-эндорфина в крови.
Кроме того, определено, что для мужчин с ОМ характерно достоверное снижение содержания в крови тестостерона и кортизола (р < 0,01) и некоторое повышение уровня ФСГ и ЛГ (р > 0,05).
Характерные изменения в системе ГГН отмечены у женщин, больных ОМ.
Наблюдалось достоверное снижение содержания прогестерона и эстрадиола (р < 0,01), а также относительное повышение ЛГ (р < 0,05) и тенденция к снижению ФСГ (р > 0,05). Уровень тестостерона был достоверно повышен (р < 0,01), а содержание в крови кортизола оказалось сниженным (р < 0,05).
На основании полученных данных сделано заключение, что в патогенезе ОМ существенное значение имеют нарушения функций вегетативной, сосудистой и гормональной систем. Перечисленные нарушения ведут к ухудшению оксигенации и питания периферических отделов конечностей, в том числе аппарата ногтя, дестабилизации местного и общего иммунитета, что существенно снижает сопротивляемость организма грибковой инфекции.
Обследованные больные были разделены на 2 группы, в которых лечение онихомикоза было проведено разными методами.
Комплексное лечение в группе А заключалось в стандартном 3-месячном курсе системной антифунгальной терапии (250 мг тербинафина в сутки или итраконазол по 400 мг в сутки одну неделю с трехнедельных перерывом), сопровождаемом еженедельным аппаратным педикюром, смазыванием ногтевых пластин раствором антимикотика 3-4 раза в день и аппликацией озонированного персикового масла ежедневно на ночь. Кроме того, пациенты с существенными нарушениями периферического кровообращения получали курс сосудистых препаратов (например, детралекс, пентоксифиллин), вегетозами – вегетокорректоры. Микологический контроль излеченности выполнялся спустя 6 и 12 месяцев по окончании лечения, поскольку, по данным Debruyne и Coquerel (2001) время половинной элиминации итраконазола из ногтей составляет от 32 до 147 дней, тербинафина – 24-156, флуконазола – 50-87, что следовало учитывать при контрольных исследованиях излеченности. Не было установлено статистически значимых различий излеченности пациентов между получавшими тербинафин и итраконазол.
В лечении были использованы растворы антимикотиков на основе 70% этилового спирта, поскольку именно такая лекарственная форма наиболее комплементарна и физико-химическим свойствам ногтевой пластинки (гидрофильная мембрана) и свойствам антимикотиков (хорошо растворимы в низших спиртах, слабо – в воде. Были использованы 3% растворы тербинафина (растворимость в воде – 6 мг/мл, в этиловом спирте – больше 70 мг/мл) и флуконазола (растворимость в воде – 8-10 мг/мл).
Добавление пенетрантов в растворы антимикотиков (димексида, пропиленгликоля) для усиления проникающей способности может использоваться (и было применено) только при частых аппаратных чистках тонкой фрезой (бором), освобождающих дермальные карманы эпонихия над ростовой зоной ногтя и пазухи перинихия, поскольку, по литературным данным: проникновение лекарственных средств непосредственно в ногтевую пластинку в присутствии димексида может быть затруднено; отсутствует значимое прямое влияние состава основы на пенетрацию лекарственного средства в ногтевую пластинку. Во многом лечение опиралось именно на поддержании активного доступа лекарственных средств местной терапии к удаленным от поверхности ногтя пораженным тканям – за счет частых тщательных подчисток ногтевых пластин. В целом, такие процедуры были достаточно комфортны.
Из вегетокорректоров назначался тофизопам (грандаксин™) – эффективный дневной транквилизатор из группы бензодиазепинов, обладающий анксиолитическим и, менее выраженным, антидепрессивным действием, лишенный седативного, миорелаксирующего, противосудорожного действия. Действие препарата основано на оптимизации работы гипоталамических структур, в том числе центральных представительств ВНС, осуществляющих верховный контроль сосудодвигательных и ангиотрофных функций.
Из сосудистых препаратов назначался пентоксифиллин (трентал™, агапурин™) в таблетках по 100 мг, 2 раза в сутки после еды. Препарат активно улучшает оксигенацию периферических тканей, функции эндотелия и реологические свойства крови в МЦР. Основными показаниями к назначению пентоксифиллина являются нарушения периферического кровообращения, нарушения трофики тканей артериальной и или венозной природы.
При непереносимости пентоксифиллина (не менее 10-15% пациентов) назначался ксантинола никотинат, активизирующий фибринолиз, снижающий вязкость крови и агрегацию тромбоцитов. Клиническая эффективность ксантинола никотината у больных онихомикозами в целом оценена ниже, чем эффективность пентоксифиллина.
При хронической венозной недостаточности, ведущей, согласно литературным данным и результатам настоящего исследования, к грубым микроциркуляторным расстройствам, назначался детралекс. Диосмин (детралекс™), препарат группы флавоноидов со стандартизированным содержанием диосмина (90%) и гесперидина (10%). Препарат оказывает венотонизирующее и ангиопротекторное действие, понижает проницаемость капилляров, улучшает микроциркуляцию, сокращая объем капиллярного шунтирования, активизируя нутритивный капиллярный кровоток. Уменьшает венозный застой, улучшает лимфатический дренаж.
В группе А впервые применено лечение онихомикоза озонированным ™ растительным маслом, которое показало высокую эффективность – наряду с простотой использования и непревзойденной безопасностью применения. Известно, что камнем преткновения в лечении онихомикоза является медленное отрастание ногтевых пластинок, препятствующее полной элиминации патогена. Адъювантное применение озонированного персикового масла (выполнялось при тотально-дистрофическом поражении и/или существенно замедленном отрастании ногтей в виде полуокклюзионной повязки на ночь) ускоряло рост ногтевой пластинки (даже на фоне известного антиметаболического действия на онихобласты антифунгальных средств) в 2-2,5 раза, способствовало рассасыванию грибковых гранулем в глубоких слоях ногтевого ложа и быстрейшему устранению клинических признаков ониходистрофии.
Микологическое излечение определено у 99% и 98% пациентов при первом и втором микологическом контролях, соответственно – во всей выборке. У пациентов с тотально-дистрофическим поражением ногтей больших пальцев стоп показатели микологической излеченности составили 97% и 95%.
Контрольная группа получала только стандартную системную терапию. Микологический контроль определил 74% и 65% излеченных пациентов спустя 3 и 6 месяцев по окончании лечения, соответственно. Статистически достоверных различий микологической излеченности между получавшими тербинафин и итраконазол установлено не было.
ВЫВОДЫ
Проведенными исследованиями определено, что больные онихомикозом имеют существенные, статистически значимые нарушения вегетативных функций, оксигенации тканей аппарата ногтя, гормональные нарушения.
Установлено, что комплексное патогенетическое лечение онихомикоза намного превосходит эффективностью конвенциональную комбинированную (системные антимикотики плюс местное лечение) антифунгальную терапию, показав статистически достоверное преимущество даже при сравнении пациентов группы А с ТДО с эффективностью конвенциональной терапии всей контрольной группы (34,5% ТДО).
Комплексная патогенетическая терапия онихомикоза нивелирует имеющиеся у больных нарушения микроциркуляции и оксигенации, определяя высочайшую эффективность лечения, претендуя на наименование “золотым стандартом” лечения онихомикоза.
Адъювантное местное использование озонированного растительного масла оказывает бустерный эффект на рост ногтевых пластинок, санацию ногтевого ложа и ростовой зоны ногтя.
Библиография:
- Кирьянова В.В., Кияшко М.Н., Лосинская Н.Е. Озонотерапия. – СПб, 2010 – 30 с.
- Association of the British Pharmaceutical Industry. Medicines Compendium 2005. Surrey: Datapharm Communications Ltd, 2005: 2234–6.
- Bronaugh R, Maibach H. Topical Absorption of Dermatological Products, Informa Health Care, 2002. 544 pages
- Brown MB et al. Dermal and transdermal drug delivery systems: current and future prospects. Drug Deliv. 2006 May-Jun;13(3):175-87.
- Burzykowski T et al. High prevalence of foot diseases in Europe: results of the Achilles Project. Mycoses. 2003 Dec;46(11-12):496-505.
- Debruyne D, Coquerel A. Pharmacokinetics of antifungal agents in onychomycoses. Clin Pharmacokinet. 2001;40(6):441-72.
- Effendy I, Lecha M, Feuilhade de Chauvin M, Di Chiacchio N, Baran R; European Onychomycosis Observatory. Epidemiology and clinical classification of onychomycosis. J Eur Acad Dermatol Venereol. 2005 Sep;19 Suppl 1:8-12.
- Fitzpatrick TB et al. Dermatology in General Medicine. Fourth Edition.– McGraw-Hill. New York. 1993.
- Grover C. Combination of surgical avulsion and topical therapy for single nail onychomycosis: a randomized controlled trial. Br J Dermatol. 2007 Aug;157(2):364-8.
- Hay RJ. The future of onychomycosis therapy may involve a combination of approaches. Br J Dermatol. 2001;145(suppl 60):3-8.
- Kalinowski DP et al. Low-voltage direct current as a fungicidal agent for treating onychomycosis. J Am Podiatr Med Assoc. 2004 Nov-Dec;94(6):565-72.
- Kobayashi Y et al. Drug permeation through the three layers of the human nail plate. J Pharm Pharmacol. 1999 Mar;51(3):271-8.
- Kulac M et al. Venous insufficiency in patients with toenail onychomycosis. J Ultrasound Med. 2005 Aug;24(8):1085-9.
- Lee S, Bang D. Hyphae on the ventral nailplate as a clue to onychomycosis. Am J Dermatopathol. 1987 Oct;9(5):445-6.
- Neubert RH et al. Different physicochemical properties of antimycotic agents are relevant for penetration into and through human nails. Pharmazie. 2006 Jul;61(7):604-7.
- Olafsson JH, Sigurgeirsson B, Baran R. Combination therapy for onychomycosis. Br J Dermatol. 2003 Sep;149 Suppl 65:15-8.
- Roberts MS et al in: Dermatological and Transdermal Formulations
By Kenneth A. Walters. Informa Health Care, 2002
- Roberts DT, Evans EGV. Subungual dermatophytoma complicating dermatophyte onychomycosis. Brit J Derm 1998; 138: 189-190.
- Seebacher C. Limits of brief treatment of onychomycoses. Hautarzt. 1998 Sep;49(9):705-8.
- Summerbell RC et al. Onychomycosis: a critical study of techniques and criteria for confirming the etiologic significance of nondermatophytes. Med Mycol. 2005 Feb;43(1):39-59.
- Tosti A et al. Are local and systemic conditions important for the development of onychomycosis? Eur J Dermatol. 1998 Jan-Feb;8(1):41-4.
- Trommer H, Neubert RH. Overcoming the stratum corneum: the modulation of skin penetration. A review. Skin Pharmacol Physiol. 2006;19(2):106-21. Epub 2006 May 9.










